Uma Revolução Silenciosa nos Testes de Medicamentos: A Ruptura do FDA com Modelos Animais Promete um Pipeline Biofarmacêutico Mais Rápido, Barato e Ético
A Administração de Alimentos e Medicamentos dos EUA (FDA) anunciou hoje anunciou sua intenção de eliminar gradualmente os testes obrigatórios em animais para anticorpos monoclonais e outros medicamentos. A decisão, que levou anos para ser tomada e foi amplamente solicitada tanto por defensores da ética quanto por cientistas clínicos, inicia uma transição radical em direção a métodos mais preditivos, eficientes e relevantes para humanos na avaliação da segurança e eficácia de medicamentos.

"É o desmantelamento de uma suposição científica centenária", disse um analista regulatório familiarizado com o processo. "Estamos nos afastando de representantes animais e entrando no reino da biologia computacional e dos sistemas humanos projetados. As implicações são vastas."
Do Laboratório Animal ao Chip de Silício: O Roteiro Inovador do FDA
Uma Nova Era da Toxicologia
O roteiro recém-revelado do FDA descreve o uso de Novas Metodologias de Abordagem (NAMs) - um conjunto de ferramentas que variam de modelos computacionais orientados por IA a organoides derivados de humanos e tecnologias de órgãos em chip. Essas ferramentas visam replicar a biologia humana com uma fidelidade muito maior do que o padrão atual: testes em animais.
Novas Metodologias de Abordagem (NAMs) referem-se a uma variedade de técnicas modernas usadas principalmente em toxicologia e avaliação de segurança. Elas englobam métodos in vitro, in silico e outros métodos não animais desenvolvidos como alternativas para substituir, reduzir ou refinar os procedimentos tradicionais de testes em animais.
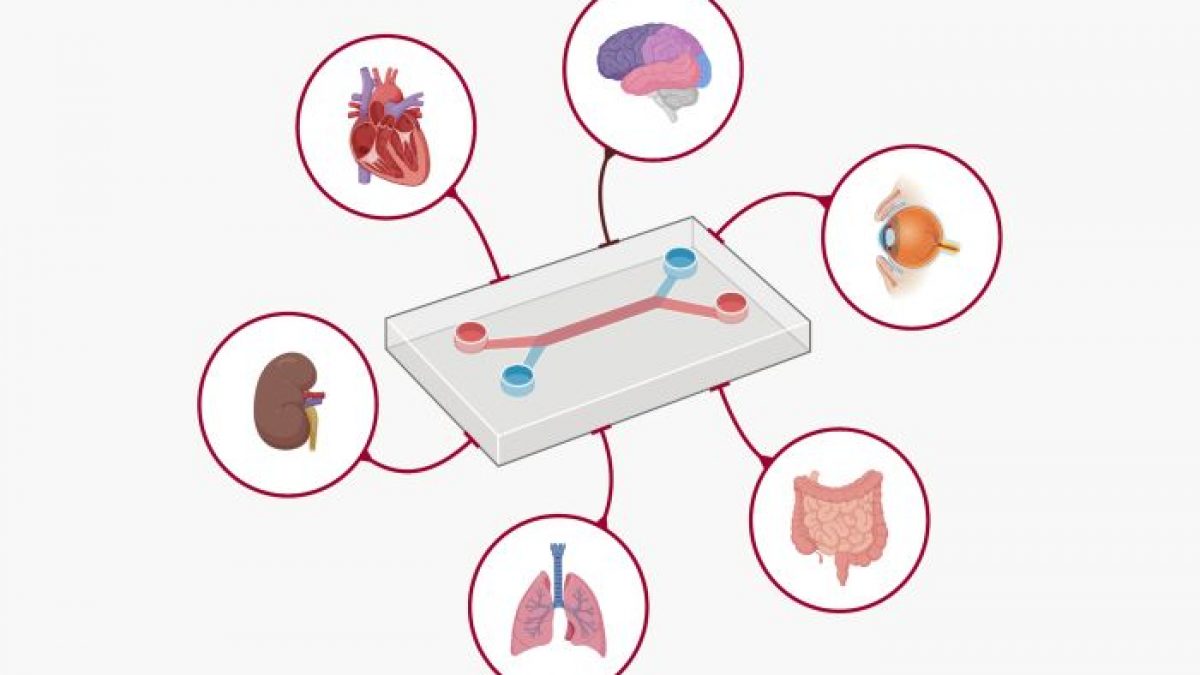
Os principais componentes da política incluem:
- Incentivo imediato aos dados de NAMs em solicitações de novos medicamentos experimentais (IND).
- Aceitação de dados de segurança humana do mundo real de reguladores internacionais comparáveis.
- Programas piloto começando este ano, permitindo que desenvolvedores selecionados enviem anticorpos monoclonais avaliados principalmente com métodos não animais.
- Incentivos regulatórios, incluindo análises simplificadas, para desenvolvedores que apresentarem dados validados de testes não animais.
"Este é um ganha-ganha", disse um toxicologista sênior. "Os medicamentos chegam aos pacientes mais rapidamente. Os custos de desenvolvimento são menores. E nos afastamos de modelos animais eticamente carregados e, muitas vezes, com baixa capacidade preditiva."
O Status Quo: Falho, Caro e Eticamente Controverso
Os Custos Ocultos dos Testes em Animais
Por décadas, os testes em animais têm sido o padrão ouro regulatório. De camundongos e ratos a cães e primatas, os animais têm sido usados para simular respostas humanas a medicamentos experimentais. Mas esses modelos geralmente ficam aquém. Uma molécula que tem um bom desempenho em um roedor pode se comportar de forma imprevisível em humanos - uma lacuna de tradução que contribuiu para inúmeros fracassos de ensaios clínicos em estágio avançado e retiradas de segurança pós-aprovação.

Taxa de falha estimada de medicamentos em ensaios clínicos após passar por testes em animais.
| Métrica | Estatística/Descoberta | Fonte/Contexto |
|---|---|---|
| Taxa Geral de Falha em Ensaios Clínicos (Pós-Testes Pré-Clínicos) | Aproximadamente 90% a 92% dos medicamentos candidatos que entram em ensaios clínicos em humanos não obtêm aprovação regulatória. | Várias fontes citam essa faixa, incluindo BIO, Cruelty Free International e artigos acadêmicos que referenciam dados da indústria (por exemplo, Sun et al., 2022). |
| Principais Razões para Falha em Ensaios Clínicos | Falta de eficácia clínica (40-50%), problemas de toxicidade/segurança (aprox. 30%), propriedades medicamentosas ruins (10-15%). | Análise citada em Sun et al. (2022) e corroborada por descobertas de que mais da metade das falhas nas fases II/III são devido à falta de eficácia. |
| Capacidade Preditiva de Modelos Animais | Altas taxas de falha em humanos (por exemplo, 92%) ocorrem apesar de resultados promissores em testes pré-clínicos, incluindo testes em animais. | Cruelty Free International, PETA, Humane Society International e revisões acadêmicas destacam a desconexão (lacuna de tradução). |
| Taxa de Sucesso por Fase Clínica (Dados Aprox. de 2011-2020) | Fase I: ~52% de sucesso; Fase II: ~29% de sucesso; Fase III: ~58% de sucesso. | Dados relatados pela BIO (Biotechnology Innovation Organization) indicam que a Fase II é um grande gargalo. |
| Taxa de Falha por Área Terapêutica (Dados Aprox. de 2011-2020, entrando em ensaios) | Urologia (~96% de falha), Cardiologia (~95% de falha), Oncologia (~95% de falha), Neurologia (~94% de falha). | Dados relatados pela BIO mostram taxas de falha muito altas em diferentes áreas de doenças. |
A "lacuna de tradução" no desenvolvimento de medicamentos refere-se à dificuldade significativa e à alta taxa de falha encontrada ao tentar traduzir descobertas científicas básicas promissoras do laboratório ("bancada") em tratamentos eficazes e seguros para pacientes humanos ("cabeceira"). Um desafio primário é que os modelos pré-clínicos, particularmente os estudos em animais, muitas vezes não conseguem prever com precisão como um medicamento potencial se comportará em humanos.
Além disso, os testes em animais são notoriamente caros e lentos. As estimativas sugerem que podem adicionar meses ou até anos ao cronograma de desenvolvimento e inflacionar os custos de P&D em centenas de milhões de dólares.
Tabela: Comparação de Custos e Cronogramas para Testes Tradicionais em Animais vs. NAMs no Desenvolvimento Pré-Clínico de Medicamentos
| Aspecto | Testes Tradicionais em Animais | Novas Metodologias Alternativas (NAMs) |
|---|---|---|
| Custo | US$ 2–US$ 4 milhões por estudo; alta variabilidade | Custos mais baixos devido à automação e eficiência |
| Cronograma | 4–10 anos para estudos abrangentes | Saídas rápidas (semanas a meses) |
| Eficiência | Valor preditivo limitado para a biologia humana | Alto rendimento e relevante para humanos |
| Desafios | Necessário para avaliações complexas de longo prazo; requisitos regulatórios | Não pode replicar totalmente sistemas complexos; adoção regulatória limitada |
Depois, há o cálculo ético. A cada ano, dezenas de milhares de animais são usados no desenvolvimento de medicamentos nos EUA. Muitos desses experimentos envolvem procedimentos invasivos sem possibilidade de recuperação. Sob esta luz, a mudança do FDA não é apenas um salto científico - mas um ponto de inflexão ético.
Testes Relevantes para Humanos: Precisão Sem a Dor
Modelos de IA e Organoides Assumem o Centro do Palco
O que substitui o modelo antigo? Uma poderosa confluência de tecnologias antes consideradas futuristas:
-
Toxicologia de Inteligência Artificial: Ferramentas de IA treinadas em milhões de pontos de dados agora podem simular como os medicamentos se comportam em tecidos humanos, prevendo efeitos colaterais e toxicidade de órgãos com precisão crescente. Alguns modelos podem mapear a distribuição de anticorpos monoclonais através do corpo humano in silico - sem um único animal de laboratório.
-
Organoides e Sistemas de Órgãos em Chip: Esses tecidos humanos cultivados em laboratório - versões minúsculas de órgãos como fígado, coração ou sistema imunológico - oferecem uma janela direta para a biologia humana. Os pesquisadores agora podem observar como os medicamentos afetam as células humanas reais em tempo real.
Um dos primeiros a adotar em uma empresa de biotecnologia de médio porte observou: "Em nosso recente programa de anticorpos monoclonais, os modelos de organoides detectaram hepatotoxicidade que nossos modelos de rato perderam completamente. Isso não é apenas eficiência. Isso é segurança do paciente."
Quem Ganha, Quem Perde: Uma Indústria Reequilibrada
Vencedores: Inovadores Impulsionados pela Tecnologia e Biotechs Ágeis
Para as empresas que há muito investem em testes relevantes para humanos, a decisão do FDA é uma vindicação - e um claro vento favorável. Estes incluem:
- Biotechs que aproveitam sistemas de organoides e in vitro, capazes de reduzir seus cronogramas pré-clínicos em até 40%.
- Desenvolvedores de plataformas de IA, construindo modelos preditivos de toxicologia que as grandes empresas farmacêuticas estão agora correndo para licenciar.
- Organizações de Pesquisa Contratada (CROs) que mudaram cedo de testes em animais para ensaios baseados em células e simulações de silício.

Os investidores já tomaram nota. "Vemos isso como um vento favorável secular de cinco anos para qualquer player envolvido em testes alternativos", disse um gestor de portfólio em um fundo de hedge focado em ciências da vida.
Perdedores: Empresas de Testes Tradicionais em Animais em Risco
O impacto nas CROs tradicionais de testes em animais é mais preocupante. Os relatórios indicam uma queda de 28% nas ações da Charles River Laboratories, um indicador da indústria de testes em animais, após o anúncio do FDA. Essas empresas agora enfrentam uma escolha difícil: transformar ou desaparecer.
Gráfico de desempenho recente do preço das ações da Charles River Laboratories (CRL).
| Data | Preço de Abertura (USD) | Preço Máximo (USD) | Preço Mínimo (USD) | Preço de Fechamento (USD) | Volume |
|---|---|---|---|---|---|
| 2025-04-09 | 121,71 | 139,31 | 117,26 | 139,07 | 1.974.894 |
| 2025-04-08 | 136,86 | 137,96 | 122,06 | 123,61 | 1.586.299 |
| 2025-04-07 | 132,79 | 139,16 | 128,03 | 134,07 | 1.984.859 |
"É como a transição do filme para o digital na fotografia", disse um analista. "Só que desta vez, as apostas são bilhões em receita de P&D."
O Caminho Adiante: Validação, Transição e Resistência
Coordenação Regulatória e Implicações Globais
Embora o roteiro ofereça clareza, a transição está longe de estar completa. Um desafio fundamental será a validação - provar que esses novos métodos preveem resultados humanos melhor do que os animais, de forma consistente e em todos os tipos de medicamentos.
A validação para Novas Metodologias de Abordagem (NAMs) refere-se ao processo de estabelecer sua confiabilidade e relevância científica para um propósito específico pretendido, como testes de toxicidade. Isso normalmente envolve a adesão a critérios científicos definidos e processos formais, muitas vezes orientados por órgãos reguladores como o FDA, para garantir que o método alternativo seja adequado ao propósito.
O FDA, em parceria com o NIH, o Programa Nacional de Toxicologia e o Departamento de Assuntos de Veteranos, está convocando um workshop público ainda este ano. Ele solicitará feedback e refinará os cronogramas de implementação. Um programa piloto lançado este ano testará o roteiro em condições do mundo real, provavelmente moldando uma orientação mais ampla em 2026 e além.
Outras agências regulatórias estão observando de perto. Caso a iniciativa do FDA seja bem-sucedida, a harmonização global pode seguir, com reguladores europeus, canadenses e asiáticos potencialmente se movendo para alinhar os padrões - uma mudança que simplificaria drasticamente o desenvolvimento internacional de medicamentos.
Análise de Mercado: Risco, Rotação e Recompensa
A Tese de Investimento em Biofarmacêutica na Esteira da Agitação Regulatória
Do ponto de vista dos mercados de capitais, a mudança do FDA é uma das mudanças regulatórias mais consequentes em décadas.
- Os modelos de P&D de biofarmacêutica serão comprimidos, com cronogramas encurtando em meses - se não anos.
- As margens de lucro podem aumentar à medida que as empresas reduzem os custos associados a longos ciclos de testes em animais e protocolos de segurança redundantes.
- A atividade de fusões e aquisições provavelmente aumentará, com CROs com conhecimento de tecnologia e empresas de modelagem de IA se tornando alvos atraentes.
Crescimento projetado do mercado para Novas Metodologias de Abordagem (NAMs) vs. previsão do mercado tradicional de testes em animais.
| Segmento de Mercado | Região/Escopo | Valor do Ano Base (Aprox.) | Valor Projetado (Aprox.) | CAGR (Aprox.) | Período de Previsão | Notas da Fonte |
|---|---|---|---|---|---|---|
| Testes Alternativos Não Animais (NAMs) | Global | US$ 1,11 Bilhões (2019) | - | 6,34% | 2023-2028 | Vários relatórios indicam um crescimento significativo, impulsionado por preocupações éticas e impulsos regulatórios (por exemplo, princípios dos 3Rs). Inclui métodos in vitro, in silico, órgão em chip. |
| Testes Alternativos Não Animais (NAMs) | Global | US$ 9,8 Bilhões (2021) | US$ 29,4 Bilhões (2030) | 13,5% | 2022-2030 | Outra previsão mostrando um crescimento ainda maior, potencialmente incluindo uma definição mais ampla de NAMs ou um escopo de mercado diferente. Enfatiza o apoio do governo e tecnologias como órgãos em chip. |
| Testes Alternativos Não Animais (NAMs) | Global | US$ 1,8 Bilhões (2023) | - | 11,9% | 2024-2032 | Destaca os crescentes investimentos, preocupações éticas, apoio regulatório (FDA/UE) e avanços tecnológicos (órgão em chip, modelos de tecido 3D) como principais impulsionadores. |
| Testes de Toxicologia In Vitro (Componente de NAMs) | Global | US$ 10,99 Bilhões (2023) | US$ 30,06 Bilhões (2033) | 10,82% | 2024-2033 | Representa uma parte significativa do mercado de NAMs, mostrando um forte crescimento impulsionado pela descoberta de medicamentos, segurança química e aceitação regulatória. Várias fontes mostram CAGRs semelhantes (10,8%-11,2%). |
| Mercado de Organoides (Tecnologia NAM específica) | Global | - | US$ 3,3 Bilhões (2027) | 21,7% | Próximos 3 anos | Tecnologia NAM específica mostrando um potencial de crescimento muito alto, refletindo avanços em modelagem biológica complexa. |
| Testes Tradicionais em Animais | Global | US$ 10,74 Bilhões (2019) | - | 1,03% | 2023-2028 | Mostra um crescimento significativamente mais lento em comparação com NAMs, atribuído a pressões éticas, adoção dos princípios dos 3Rs e mudanças regulatórias (por exemplo, meta da EPA de acabar com os testes em mamíferos até 2035). |
| Testes Tradicionais em Animais | Global | US$ 10,74 Bilhões (2019) | - | 2,64% | 2028-2035 | A previsão indica um crescimento ligeiramente maior no período posterior, mas ainda substancialmente menor do que NAMs. |
| Mercado de Modelos Animais | Global | US$ 1,9 Bilhões (2022) | US$ 3,6 Bilhões (2032) | 6,6% | 2023-2032 | Esta previsão se concentra especificamente no mercado para os próprios animais, mostrando um crescimento moderado, provavelmente impulsionado pelas necessidades contínuas de P&D, apesar do impulso para alternativas. |
Ao mesmo tempo, o risco paira sobre os adotantes lentos. "Os investidores precisam ser implacavelmente seletivos", disse um gestor de fundos. "Esta não é uma maré crescente. É uma mudança sísmica. Alguns barcos subirão. Outros afundarão."
Uma Revolução Silenciosa e Humana
A decisão do FDA de acabar com os testes obrigatórios em animais para anticorpos monoclonais é mais do que uma atualização regulatória. É o início silencioso de uma transformação biomédica, que promete curas mais rápidas, preços de medicamentos mais baixos, melhor ciência e menos gaiolas.
E para os investidores mais sofisticados do mundo, marca o início de uma nova época de investimento - uma que recompensa a previsão tecnológica, a liderança ética e a ciência centrada no ser humano.
Em um mundo de ruído, às vezes as revoluções mais significativas começam com o zumbido suave de um chip de silício - substituindo o guincho de um rato de laboratório.
